Techniques de cryoconservation en médecine de la reproduction : améliorer la survie cellulaire après le réchauffement.
Une récente revue de la littérature présente les progrès des techniques de cryoconservation. Le concept de vitrification est présenté comme crucial pour assurer la survie cellulaire après cryoconservation.
Une revue de la littérature récemment publiée présente un aperçu approfondi des processus physiques de cryoconservation. La cryoconservation des gamètes et des embryons humains a pris une place importante dans le traitement de fertilité, notamment pour la fécondation in vitro (FIV). Par exemple, la congélation des embryons surnuméraires est devenue nécessaire avec l’avènement de la stimulation hormonale qui permet de récolter plusieurs ovocytes par cycle. Le développement de diverses méthodes de cryoconservation pour l’application dans les techniques de la procréation médicalement assistée (PMA) ne cesse de progresser.
Selon les auteurs, le principal défi dans le développement des techniques de cryoconservation dès le départ était de refroidir le matériel biologique de la température ambiante à −196 °C, tout en assurant le maintien de la fonction cellulaire et de l’intégrité des organites cellulaires et des membranes après la décongélation.
Le concept de vitrification
Il y a près de 80 ans, le Dr Basile Luyet a mis en évidence des facteurs clés pouvant assurer la viabilité de tous les types de cellules soumis à la cryoconservation. Selon le Dr Luyet, la première cause de mortalité cellulaire était le changement d’état d’agrégation de l’eau liquide en cristaux de glace dans le compartiment intracellulaire. Pour contrer le processus de cristallisation, Luyet a introduit le concept de vitrification. Le principe général de la vitrification est de transformer un liquide en un solide amorphe ou vitreux, dépourvu de toute structure cristalline (d’apparence similaire à du verre).
Au milieu des années 1990, l’intérêt pour la vitrification a commencé à se développer dans le contexte de la PMA, avec des résultats de plus en plus probants.
La solidification de l’eau pure sous forme solide vitrée (vitrification) est obtenue lorsque la température diminue extrêmement rapidement en dessous de la température de transition vitreuse (Tg; Figure 1). On a constaté que la Tg pour l’eau pure est de −137 °C et n’est possible qu’avec une vitesse de refroidissement (C) supérieure à 100.000 °C/min pour éviter la formation spontanée de cristaux (ou nucléation) lors du franchissement de la zone comprise entre la température de fusion (Tm) et la Tg. À des vitesses de refroidissement lentes, la formation de cristaux est directement observée : l’eau pure prend une couleur laiteuse. Inversement, à des vitesses de refroidissement extrêmement élevées, un état solide vitreux est observé lorsque l’eau pure atteint la Tg : l’eau pure présente alors un aspect transparent.
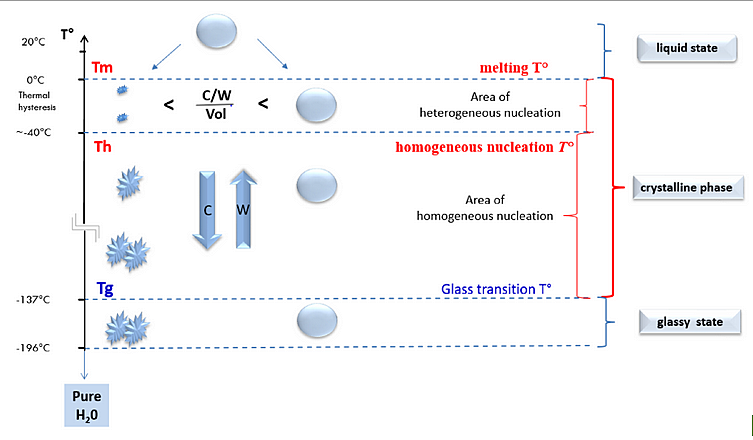
Selon les auteurs, les recherches ont montré que le matériel biologique ne peut survivre à des températures très basses sans l’utilisation d’agents cryoprotecteurs solubles dans l’eau (CPA). Les CPA augmentent la viscosité et entraînent ainsi à un ralentissement des mouvements moléculaires de l’eau. Il en résulte une réduction du taux de formation des cristaux de glace et une limitation de la taille des cristaux, entre autres effets. Les auteurs ont noté que les solutions de cryoconservation contenant des sels, des acides aminés, des protéines et des CPA présentent différentes températures de changement de phase. La modification de ces paramètres dépend de la concentration et de la composition respectives des solutés moléculaires et des CPA.
La question fondamentale dans toutes les méthodes de vitrification est d’atteindre et de maintenir des conditions à l’intérieur et à l’extérieur des cellules qui garantissent un état vitreux tout au long du refroidissement, ainsi que pendant le processus de réchauffement. Cet état est atteint lorsque les solutés sont suffisamment concentrés, ou lorsque le refroidissement est suffisamment rapide, pour que l’augmentation de la viscosité empêche la nucléation et la formation de cristaux de glace.
La vitrification intracellulaire : un facteur clé pour la réussite des procédures de cryoconservation
La vitrification intracellulaire : un facteur clé pour la réussite des procédures de cryoconservation
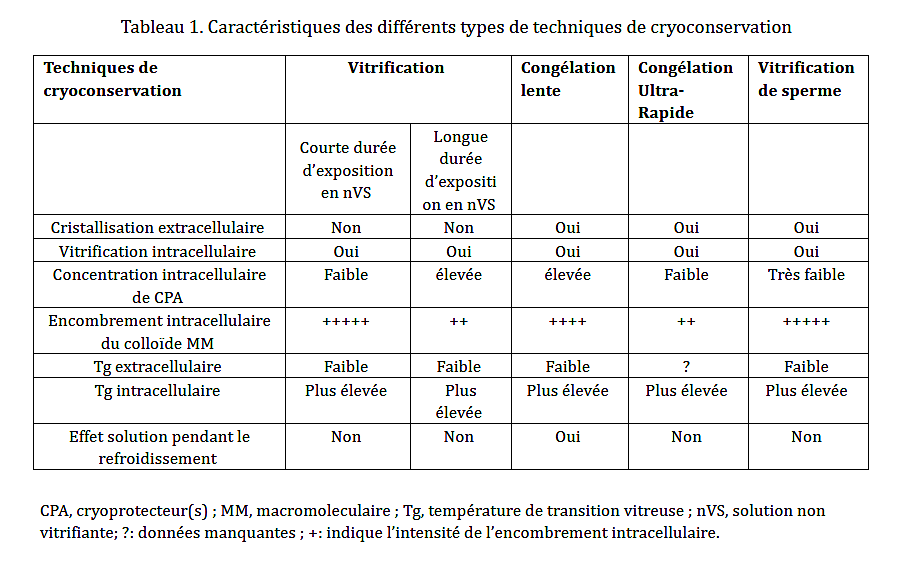
Il existe plusieurs approches pour la cryoconservation de gamètes (ovocytes ou spermatozoïdes) et d’embryons (voir le tableau 1) :
- le protocole conventionnel de vitrification utilisant une forte concentration de CPA perméables et des vitesses de refroidissement/réchauffement élevées ;
- le protocole de congélation lente avec l’application de concentrations sensiblement plus faibles de CPA perméables et d’une faible vitesse de refroidissement ;
- la congélation directionnelle avec CPA perméable et un contrôle précis de l’effet de solution ;
- la méthode de cryoconservation des spermatozoïdes sans l’utilisation de CPA perméables.
Avant de refroidir des gamètes ou des embryons jusqu’à −196 °C dans de l’azote liquide, le compartiment intracellulaire doit être préparé pour permettre l’obtention et le maintien d’un état intracellulaire vitreux. Pour atteindre cet objectif, le matériel biologique est exposé à des concentrations croissantes de solution non vitrifiante (nVS) et de solution vitrifiante (VS).
Indépendamment du protocole utilisé pour la cryoconservation, le dénominateur commun pour la survie cellulaire après cryoconservation est l’obtention d’un état vitreux colloïdal intracellulaire. Dans une solution aqueuse, un état vitreux peut être observé après un refroidissement ultra-rapide. En revanche, le compartiment intracellulaire sera vitrifié, en raison d’une augmentation immense de la viscosité après déshydratation, de l’encombrement macromoléculaire, et de l’imprégnation en CPA.
Pour plus de détails sur les principes chimiques et physiques sous-jacents, l’étude complète est disponible sur FRIDOC.
Source
Vanderzwalmen, P.; Ectors, F.; Panagiotidis, Y.; Schuff, M.; Murtinger, M.; Wirleitner, B. The Evolution of the Cryopreservation Techniques in Reproductive Medicine—Exploring the Character of the Vitrified State Intra- and Extracellularly to Better Understand Cell Survival after Cryopreservation. Reprod. Med. 2020, 1, 142-157. https://doi.org/10.3390/reprodmed1020011
